Acidification, eutrophisation et pollution photochimique
Acidification et eutrophisation
La pollution acide est liée aux émissions de SO2, NOx mais aussi celles de NH3 des activités humaines qui retombent en partie à proximité des sources mais aussi à des centaines, voire des milliers de kilomètres (la durée de vie du SO2 dans l’atmosphère est de l’ordre de 2 à 5 jours) de leurs sources émettrices. L’eutrophisation est principalement liée aux dépôts d’azote provenant des émissions de NOx et de NH3. Ces polluants se transforment et retombent sous forme de retombées sèches ou humides. SO2 et NOx se transforment respectivement en sulfates et en nitrates ainsi qu’en acide sulfurique et en acide nitrique selon les conditions. Le NH3, émis principalement par les activités agricoles, se transforme aussi en ammonium. Il contribue également à l’acidification des milieux. Son potentiel d’acidification est équivalent à celui des NOx. Les retombées d’azote issues des émissions de NOx et NH3 conduisent à enrichir les milieux et à en modifier les équilibres chimiques. L’acidification de l’atmosphère est connue depuis très longtemps dans les zones urbaines et/ou industrielles sous le nom bien connu de « smog acide » (ou smog londonien). Ce type de smog tend à disparaître depuis quelques dizaines d’années de l’atmosphère des grandes zones urbaines européennes (mais il caractérise encore l’atmosphère de beaucoup de zones urbaines de pays en voie de développement). Les phénomènes de pollution acide à grande échelle ont été mis en évidence par l’acidification des eaux des lacs scandinaves et canadiens dans les années 70. Le pH des eaux est devenu acide, entraînant des modifications importantes de la faune piscicole par exemple. Certaines pluies avait un pH compris entre 3 et 4 alors que l’acidité naturelle de l’eau de pluie est de 5,6. Ces polluants sont transportés à grande distance. La France impacte les pays voisins sur un domaine plus ou moins étendu mais elle est impactée aussi par les pays voisins. Pour caractériser la sensibilité des milieux, la notion de charges critiques a été définie. Les charges critiques sont déterminées sur la base de critères géologiques, pédologiques, hydrologiques, écologiques. Pour ce qui concerne les dépôts acides, la charge critique est définie ainsi : « Dépôt de composés acidifiants le plus élevé qui ne puisse causer de dysfonctionnement chimique des sols susceptible d’entraîner des altérations à long terme sur la structure et le fonctionnement des écosystèmes ».
Les retombées acides ont les effets suivants :
- Acidification des lacs : grâce à l’étude de certains fossiles (certains animaux aquatiques sont caractéristiques d’une plage de pH), il a été établi que le pH des lacs est resté constant jusque vers 1950. Il s’est abaissé brusquement après. L’acidification de l’eau perturbe la faune piscicole et peut même la détruire complètement en cas de pH faible.
- Dépérissement des forêts : le dépérissement des forêts atteint aussi bien les conifères que les arbres à feuilles caduques. Les nombreuses recherches réalisées sur le dépérissement des forêts ont montré qu’il y avait en fait synergie entre plusieurs phénomènes. Effets des sécheresses (ces effets sont renforcés par la présence de SO2 et de l’ozone) ; dépôts acides secs ou humides qui provoquent un lessivage des éléments nutritifs des sols ; action directe de SO2 ou NOx sur la physiologie des plantes.
- La charge critique pour les dépôts acides est donc la valeur des retombées qu’il ne faut pas dépasser pour maintenir la capacité de neutralisation des sols, permettant le maintien des paramètres vitaux pour la faune ou la flore. Ces paramètres peuvent être le pH des sols, des eaux de surface, les teneurs en calcium et en aluminium en solution, la combinaison de ces paramètres…
Les effets des dépôts acides variant géographiquement en fonction de la sensibilité des écosystèmes, la charge critique est déterminée pour chaque milieu. Un vaste travail de cartographie est donc mené.
Les dépôts d’azote dans un écosystème en modifient progressivement la composition floristique et diminuent la biodiversité. Les espèces nitrophiles, par exemple, se développent aux dépens des espèces qui préfèrent les sols moins riches. La biodiversité s’en trouve diminuée.
L’établissement de la Convention sur le transport de la pollution atmosphérique transfrontière à longue distance (LRTAP) en 1979, de ses Protocoles limitant les émissions de SO2, NOx, COV, PM et NH3 (Notamment Protocole de Göteborg multi-polluants, multi-effets de 1999 et 2012) et des directives européennes limitant aussi les émissions de ces même polluants (directive européenne 2001/81/CE sur les plafonds d’émissions de polluants) ont permis des réductions significatifs des impacts sur les écosystèmes. Il est à noter que la mise au point du Protocole de Göteborg (1999, 2012) et des directives 2001/81 et 2284 /2016, est basée sur des objectifs de réduction des impacts des polluants sur la santé et les écosystèmes. Les plafonds d’émissions sont déterminés pour chaque pays, avec pour objectif, parmi d’autres, de réduire les niveaux de dépassement des charges critiques.
En termes d’impacts sur les écosystèmes, les progrès sont réels comme en témoigne les 2 figures suivantes (MAAS 2016) :
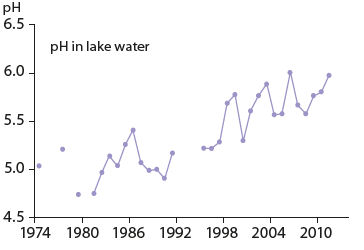
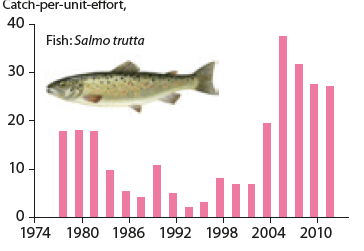
Récupération de l’acidification au lac Saudlandsvatn, en Norvège. Les dépôts de soufre ayant diminué, le pH de l’eau du lac a augmenté et les populations d’une espèce sensible ont commencé à se reconstituer (CLRTAP 2016)
|
|
|
|
|
|
|
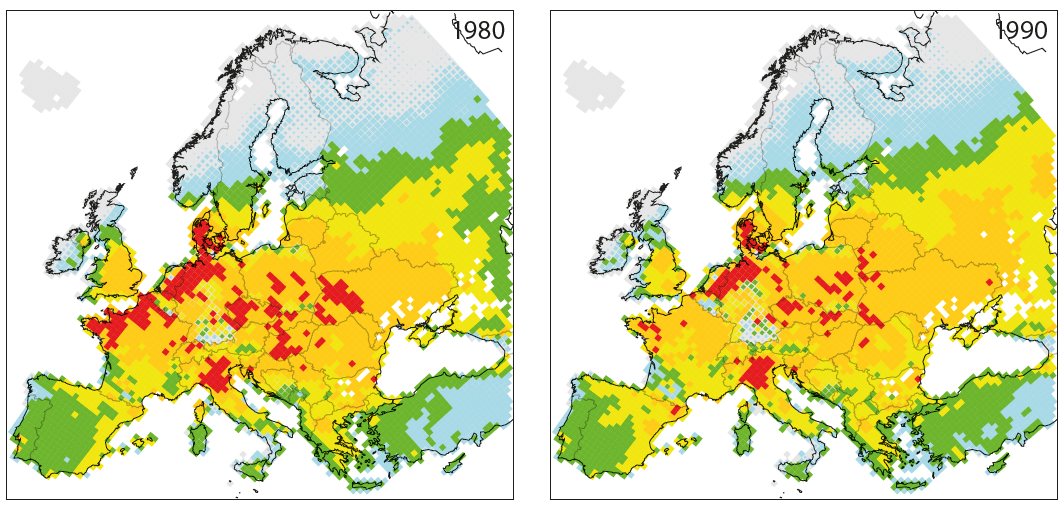
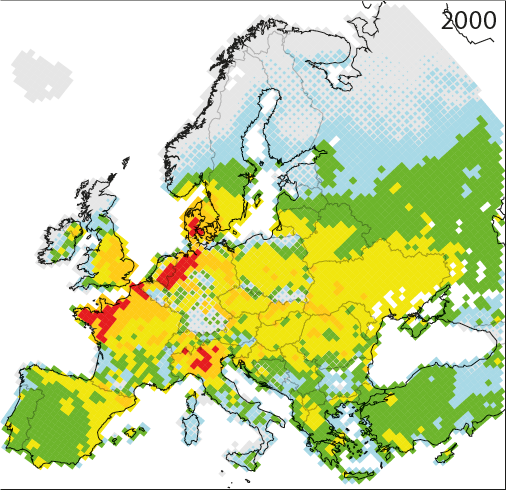
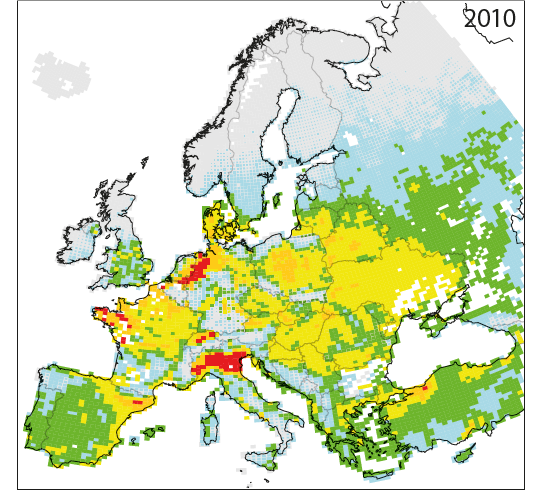
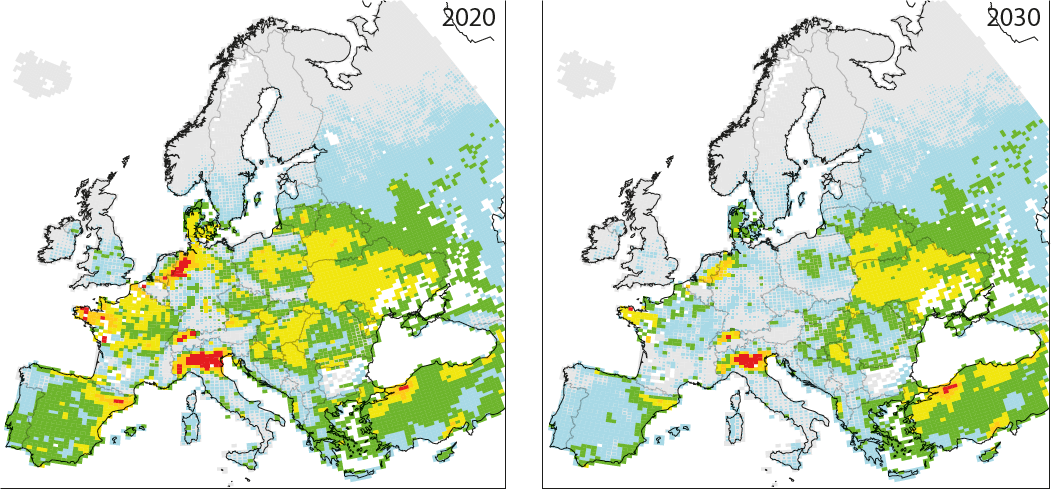
Dépassement moyen cumulé des charges critiques calculées pour l’eutrophisation de 1980 à 2020 en vertu du Protocole de Göteborg amendé de 2012 (scénario GP-CLE) et en 2030 sous un scénario de réduction maximale réalisable (MAAS 2016). |
Pollution photochimique – ozone troposphérique
La pollution photochimique (ou pollution photo-oxydante) est un ensemble de phénomènes complexes conduisant à la formation d’ozone (O3) et d’autres composés oxydants (tels que peroxyde d’hydrogène, aldéhydes, peroxy acétyl nitrate (PAN)) à partir de polluants primaires (appelés précurseurs) : oxydes d’azote (NOx), composés organiques volatils non méthaniques (COVNM), monoxyde de carbone (CO) et méthane (CH4), et d’énergie apportée par le rayonnement ultra-violet (UV) solaire. Cette pollution atmosphérique riche en ozone, appelée aussi « smog », se rencontre dans la basse couche de l’atmosphère, ou troposphère (0 à 8-10 km d’altitude). La durée de vie de l’ozone dans la troposphère est de quelques semaines mais cette durée de vie est plus courte au niveau de la couche limite (partie de l’atmosphère sensible à la présence de la surface terrestre (continentale ou océanique). Son épaisseur varie de quelques centaines de m (la nuit) à 2 à 3 km (le jour)).
L’ozone et les oxydants photochimiques sont des polluants secondaires. Les réactions chimiques mises en jeu sont complexes mais peuvent être représentées de façon simplifiée. Elles mettent en jeu en atmosphère polluée, le NO2 et des COV, polluants primaires ou précurseurs.
Le NO2 est dissocié sous l’action du rayonnement UV, à des longueurs d’ondes λ < 430 nm :
NO2 + h ν→ NO + O [a]
L’oxygène atomique ainsi créé réagit avec l’oxygène moléculaire pour former l’ozone , molécule constituée de 3 atomes d’oxygène :
O + O2 → O3 [b]
L’ozone réagit avec le monoxyde d’azote pour redonner NO2 :
O3 + NO → NO2 + O2 [c]
Le NO est qualifié de « puits d’ozone » puisqu’il contribue à limiter la concentration d’ozone en le consommant. Les concentrations d’ozone dépendent du rapport entre concentrations de NO2 et concentrations de NO. Sans présence de COV, l’ozone est peu abondant.
En présence de COV, un ensemble complexe de réactions se met en route et conduit à l’accumulation d’ozone. Ces réactions enrichissent le réservoir atmosphérique en NO2 en consommant du NO [selon la réaction f décrite ci-dessous] qui ne peut plus jouer son rôle de puits d’ozone [réaction c]. Il y a production de NO2 sans destruction d’ozone. La décomposition des COV est déclenchée par le radical OH (radical hydroxyle) qui est très réactif et présent de façon naturelle dans l’atmosphère.
RH + OH → R + H2O [d]
(RH est une représentation simplifiée d’un COV, R représentant une molécule organique associée à l’hydrogène)
R + O2 → RO2 [e]
RO2 + NO → NO2 + RO [f]
Ces réactions génèrent de nombreuses espèces organiques gazeuses et notamment des composés organiques nitrés tel que le péroxyacétylnitrate (PAN).
Les conditions météorologiques favorisant l’apparition de fortes concentrations d’ozone sont notamment :
- une température élevée de l’air,
- une faible teneur en humidité de l’air,
- une longue durée d’ensoleillement,
- une forte irradiation,
- une faible vitesse synoptique du vent (vents à grande échelle par opposition aux vents locaux).
La pollution photochimique est un phénomène caractéristique des situations estivales anticycloniques.
Une des caractéristiques importantes de la chimie atmosphérique est son caractère non linéaire. Cela signifie que la production d’ozone n’est pas proportionnelle aux teneurs en précurseurs. Selon l’abondance relative des divers composés, ce sont les réactions de formation ou de destruction qui sont favorisées.
C’est ce qui explique que, de façon surprenante, les concentrations d’ozone mesurées loin des sources des précurseurs (une agglomération par exemple) sont plus élevées que celles mesurées près des sources émettrices elles-mêmes. Ainsi, les zones suburbaines et rurales sont plus touchées que les zones urbaines par les phénomènes de pointes de concentrations en ozone. En effet, sur une ville par exemple, les émissions de NO (liées au trafic notamment) sont élevées. L’ozone susceptible de se former est rapidement détruit par le NO présent en forte concentration. Si le nuage de polluants formé sur la ville se déplace à la campagne, où les émissions de NO sont moindres, les concentrations d’ozone augmentent puisque l’ozone n’est plus consommé.
De façon générale, les stratégies de réduction devraient se concentrer sur les précurseurs les moins présents (COV et NOx) présentant un caractère limitant dans la chimie (SEIGNEUR 2018). Pour aller plus loin, cette dernière référence présente, de façon assez synthétique, cette chimie de l’atmosphère.
En France et en Europe, les concentrations de fonds en ozone n’ont pas diminué significativement malgré la baisse des émissions des précurseurs NOx et COVNM. Les niveaux de concentrations observés lors des épisodes de fortes concentrations en ozone ont par contre, diminué sous l’impact de ces réductions. Cette évolution est présentée par la figure suivante :
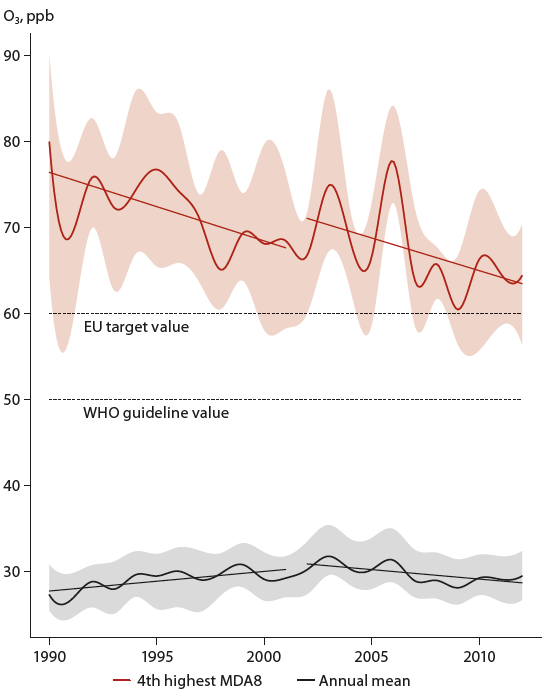
Evolution des pics de concentration d’ozone (4ème plus haut niveau quotidien des concentrations en ozone moyennes sur 8 heures) et les concentrations moyennes annuelles sur les 54 stations de surveillance EMEP avec une couverture de données satisfaisante. Les lignes indiquent la médiane et les zones ombrées les 25 et 75 percentiles. Les lignes de tendance sont indicatives pour les périodes 1990-2002 et 2002-2012 (MAAS 2016).
Sous l’impact de l’augmentation des températures qui favorise la formation d’ozone troposphérique et l’impact du transport des polluants à grande échelle, la réduction des concentrations d’ozone de fonds passe aujourd’hui par une action de réduction des émissions de NOx et de CH4 à grande échelle (Amann, 2018), (MAAS, 2016)
Impacts de l’ozone sur la santé humaine et les végétaux
L’ozone troposphérique a un impact sur la santé humaine. Il entraîne une irritation des voies respiratoires et des yeux, une baisse des performances physiques et une détérioration de la fonction pulmonaire. Dans l’Union européenne, le nombre de décès prématurés en 2015, dus à l’exposition aux PM2,5, au NO2 et à l’ozone est estimé respectivement à 391 000, 76 000 et 16 400 selon l’Agence de l’environnement européenne (AEE, 2018). Pour la France, ces morts prématurées sont respectivement de 35 800, 9 700 et 1 800 en 2015.
L’ozone perturbe l’activité photosynthétique des plantes et altère leur résistance. L’ozone attaque les plantes par leurs stomates. Les plantes absorbent moins d’ozone par temps sec que par temps humide. En effet, les stomates se referment par temps sec pour protéger la plante de la sècheresse et la protège de ce fait de l’ozone. Les plantes sont plus ou moins sensibles à l’ozone. Ce dernier provoque des dégâts visibles sur le feuillage (jaunissement par exemple) et entraîne des déficits en croissance. Des études montrent que la productivité des cultures diminue avec la présence d’ozone, figure 4.
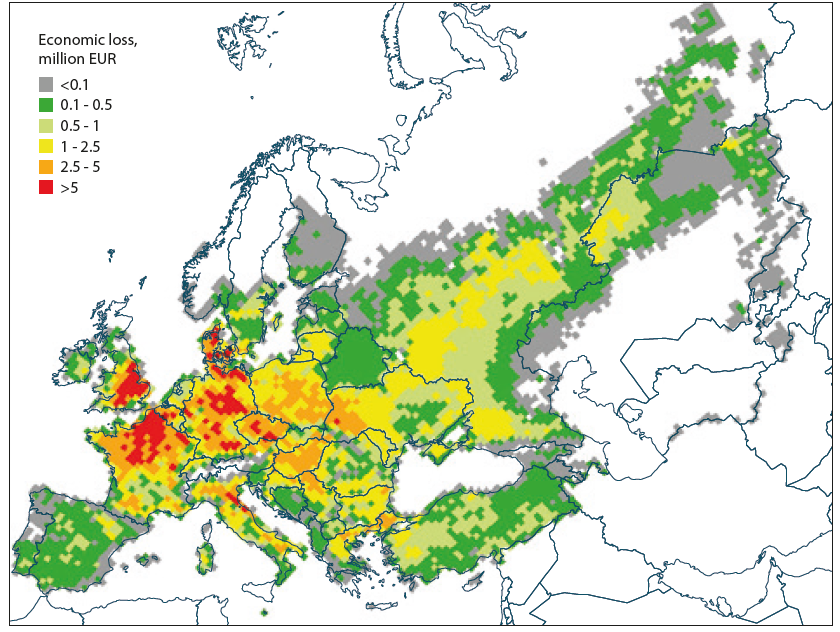
Pertes de rendement du blé (millions d’euros par réseau selon grille 50 à 50 km2), en utilisant une espèce de blé (Rain-fed-wheet) (valeur de production pour 2000, (www.fao.org/nr/gaez/en/), le calcul l’ozone moyen flux pour les cultures (http://emep.int/mscw/index_mscw.html), et les prix moyens du blé pour la période 2007 à 2011).
L’ozone et les polluants photochimiques accentuent également le pouvoir acidifiant des oxydes de soufre et d’azote, en accélérant l’oxydation de ces composés en sulfates et nitrates. La pollution oxydante et la pollution acide agissent de façon combinée sur la végétation et contribuent aux troubles des forêts.
L’ozone réduit également la capacité de stockage de carbone par les plantes.
Impact de la nature des COV sur la formation d’ozone
Tous les COVNM n’ont pas la même réactivité dans l’atmosphère. La notion de « réactivité photochimique » a été construite pour donner une image du pouvoir de production d’ozone de chaque COVNM. Plus celle-ci est élevée, plus le COVNM participe aux mécanismes, mais la relation est loin d’être linéaire. Une méthode récente pour caractériser la réactivité photochimique, est basée sur l’estimation de la contribution réelle de chaque COVNM à la formation d’ozone dans une zone géographique déterminée, en prenant en compte les caractéristiques du milieu réactionnel (composition de l’air ambiant, caractéristiques des émissions). Cette méthode, extrêmement complexe, repose sur l’utilisation des modèles de chimie atmosphérique très sophistiqués.
Le Potentiel de Création de l’Ozone Photochimique d’un COVNM, PCOP [ou POCP en anglais] a été développé par la direction de la qualité de l’air au sein du Ministère britannique de l’Environnement par R.G. Derwent (DERWENT 1998) en utilisant un modèle photochimique. Le modèle a été utilisé pour trois trajectoires supposées représentatives de situations générales en Europe lors d’épisodes de pollution photochimique mais ne représentent pas un épisode particulier de pollution. Les contributions de chacun des COVNM initiaux dans la formation d’ozone sont obtenues en faisant tourner le modèle sur chaque trajectoire (une fois avec l’ensemble des composés et au tant de fois que de COV à étudier avec l’ensemble des COVNM sauf l’un d’entre eux dont l’émission est considérée comme nulle). Il ressort notamment que l’éthylène est un composé très actif dans les processus photochimiques. Dans l’environnement, il est l’un des COVNM dont les concentrations commencent à être bien connues et sont parmi les plus fortes. Il sert de COVNM de référence. Son indice PCOP est fixé à 100. Le PCOP d’un composé i est défini par la formule suivante :

Echelle de classification : Pouvoir élevé : PCOP > 80 | Pouvoir moyen : PCOP 40 à 60 | Pouvoir faible : PCOP 10 à 35 | Pouvoir très faible : PCOP <10 |
La réactivité des COVNM est la suivante : Aromatiques > Alcènes > Aldéhydes > Alcanes.
Toutefois, il est nécessaire de garder en mémoire que la valeur du PCOP d’un COVNM (ou tout autre indice) dépend du modèle utilisé, de la valeur de tous les paramètres rentrant dans le modèle, des conditions climatiques modélisées, du lieu de constat de la concentration d’ozone et du temps entre l’émission et le constat de la concentration d’ozone. L’exploitation directe d’un indice PCOP n’est pas possible. Il faut se rappeler que cet indice varie dans le temps et dans l’espace (Ainsi des composés initialement peu réactifs peuvent avoir un rôle prépondérant quand les COVNM les plus réactifs ont réagi). Aux Etats-Unis, le paramètre MIR (Maximum Increment Reactivity) est utilisé pour caractériser le potentiel de création d’O3. De façon générale en Europe, la réduction des émissions de COV est requise, quel que soit leur potentiel de création d’ozone. La réactivité des espèces chimiques est essentielle dans la modélisation et de mieux en mieux documentée.
Liens avec l’effet de serre
Ozone troposphérique et effet de serre
L’ozone troposphérique est impliqué dans l’effet de serre. Il est le troisième 3e gaz à effet de serre en termes de PRG après le CO2 et le CH4 selon le 5e rapport d’évaluation du GIEC [IPCC- AR5-2014]. Son forçage radiatif est de 0,40 W.m2 [IPCC- AR5-2014]. Ce gaz n’est pas encore pris en compte dans les engagements de réduction des gaz à effet de serre mis en place au niveau international dans le cadre de la Convention Cadre des Nations Unies sur les Changements Climatiques (CCNUCC). Or, pour les scientifiques, l’augmentation des concentrations de fond en ozone milite pour des actions de réduction au niveau global (Amann 2018). L’augmentation des températures liées au changement climatique favorisent les réactions conduisant à l’ozone troposphérique. En raison de l’impact de l’ozone sur la santé et les écosystèmes (voir ci-après) et donc sur le puits de carbone, l’augmentation de ces concentrations dans la troposphère, pourrait conduire à une amplification de l’effet de serre. Les scientifiques recommandent donc de ne plus se satisfaire des actions régionales de réduction des émissions des précurseurs NOx et COVNM mais bien de mettre en place des actions au niveau global et d’agir pour réduire les émissions de CH4 [MAAS, 2016].
Impact des SO2, NOx, COV et NH3 sur l’effet de serre
Les inventaires d’émissions de gaz à effet de serre comptabilisent les 7 gaz à effet de serre direct mais aussi le SO2,les NOx, le CO et les COVNM comptabilisés comme des gaz à effet de serre indirect (CCNUCC 2019). Ces quatre gaz ont une action indirecte sur l’effet de serre en tant que polluants primaires intervenant dans la formation de polluants secondaires comme l’ozone ou les aérosols. Ils n’entrent pas dans le « panier » de Kyoto.
- Le CO et les COV, s’oxydent en CO2 et contribuent à la formation d’ozone. Ils ont tous deux un forçage radiatif positif contribuant donc au réchauffement.
- Les NOx conduisent à la formation d’ozone (forçage positif), mais aussi à la formation de particules de nitrate et oxydent le CH4 (forçage négatif). Au global ils ont un forçage négatif.
- Le SO2 a un effet refroidissant, en produisant des sulfates (forçage négatif).
- Le NH3 présente lui aussi un forçage négatif en produisant des nitrates t des ions ammonium.
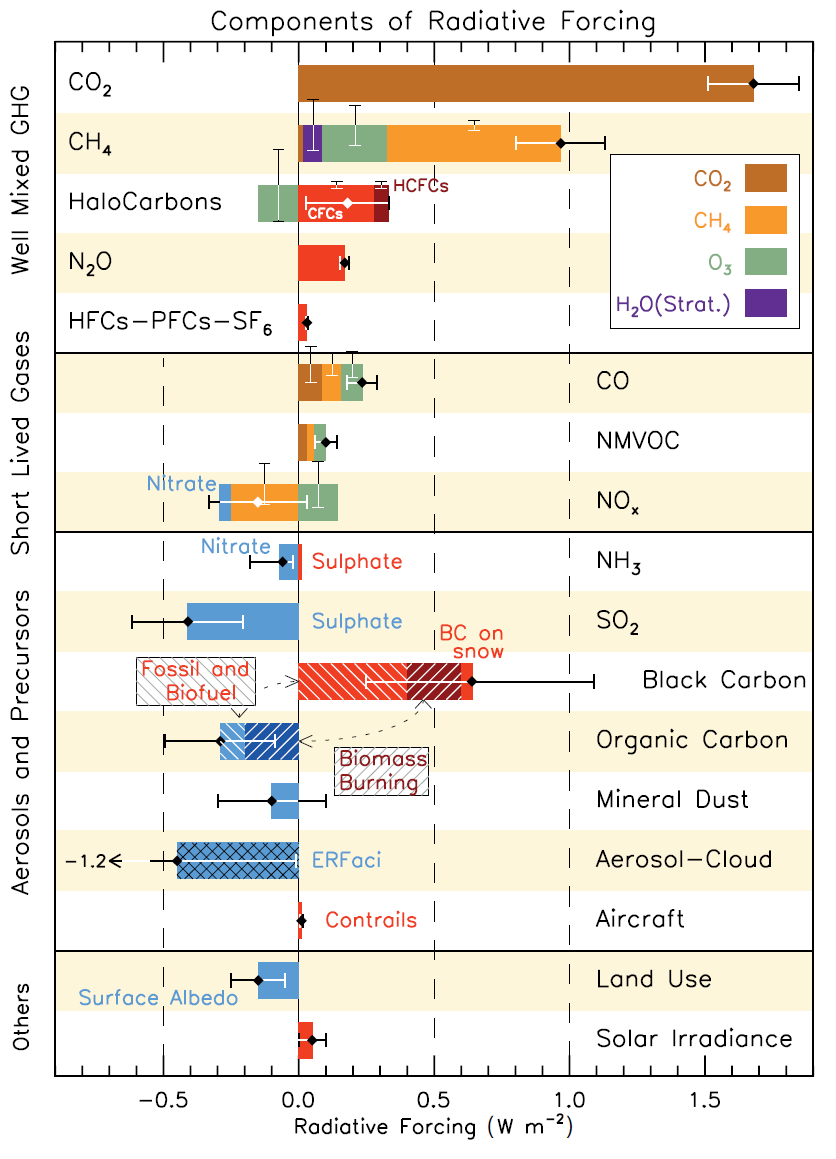
La figure suivante présente les coefficients de forçage des diverses espèces chimiques (IPCC- AR5-2014). Il est à noter que l’on ne trouve pas directement l’ozone puisqu’il est émis indirectement, mais sa contribution apparait indirectement par l’intermédiaire de ses précurseurs.
AEE 2018 – Agence de l’environnement européenne – Air quality in Europe – 2018 report. N°12. ISBN 978-92-9213-989-6 Amann 2018 – Amann M. – Ozone strategies in the context of other policy objectives – Workshop on ‘Air quality policy implementation related to ozone’ Madrid, November 21-22, 2018. CITEPA 2019 – rapport CCNUCC – Rapport National d’Inventaire pour la France au titre de la Convention cadre des Nations Unies sur les Changements Climatiques et du Protocole de Kyoto. Mars 2019 DERWENT, 1998 – Derwent, R. ; Jenkin, M. ; Saunders, S. ; Pillings, M. : Photochemical creation potentials for organic compounds in northwest Europe calculated with a master chemical mechanism – Atmospheric environment. Volume 32. n°15 – pp. 2429-2441 – 1998. Maas 2016 – Maas, R., P. Grennfelt (eds), 2016. Towards Cleaner Air. Scientific Assessment Report 2016. EMEP Steering Body and Working Group on Effects of the Convention on Long-Range Transboundary Air Pollution IPCC- AR5-2014 – Myhre, G., D. Shindell, F.-M. Bréon, W. Collins, J. Fuglestvedt, J. Huang, D. Koch, J.-F. Lamarque, D. Lee, B. Mendoza, T. Nakajima, A. Robock, G. Stephens, T. Takemura and H. Zhang, 2013: Anthropogenic and Natural Radiative Forcing. In: Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Stocker, T.F., D. Qin, G.-K. Plattner, M. Tignor, S.K. Allen, J. Boschung, A. Nauels, Y. Xia, V. Bex and P.M. Midgley (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. SEIGNEUR 2018 – Seigneur Ch. – Pollution atmosphérique – Concepts, théorie et applications – BELIN éducation – ISBN 978 -2-410-00855-5.